お知らせ・お役立ち便覧 NEWS
化学用語解説
2021.05.26
引火点と発火点

弊社の扱う有機溶剤は、多くが引火点を持っています。引火点というと、とりあえず「火が点く」というイメージがありますが、「勝手に火が点く」というわけではありません。いわゆる「発火点」と混合されがちなため、今回は「引火点」と「発火点」の違いについてご説明いたします。
引火点とは
引火点とは、点火源(火気や静電気などの火の元)を液面に近づけたときに燃焼が始まる最低温度です。
逆に、液体が引火点に達していなければ、点火源を液体に近づけても火は点きません。
下の動画を参考にしてください
※一部例外もある
例えば「石油ストーブ」のように、表面積を拡大させるような「芯」が液面にあったり、噴霧器などで霧状にした場合は引火点以下でも引火します。
よくある事例としては下記です
- 液体が染み込んだ雑巾 ←雑巾が芯となる
- 表面に埃が乗った液体 ←埃が芯となる
- 霧吹きで液体を塗布 ←霧状になっている
これらの場合は、引火点以下でも引火しますので一層注意してください。
発火点とは
引火性液体の温度が上がり続けると、点火源がなくても勝手に燃焼が始まる温度になります。
通常引火性液体は下の図のように、活性化エネルギーの山を越えないと燃焼が始まりません。しかし、温度が上がるにつれ、活性化エネルギーの山が低くなり、山がなくなると自然と燃焼を始めます。
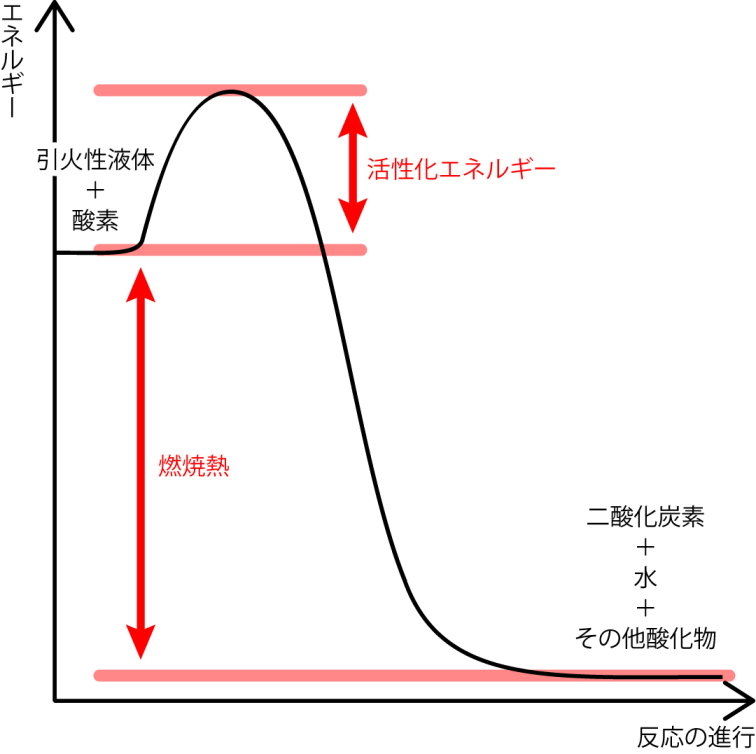
軽油は、発火性の高さを「セタン価」で示し、ガソリンは発火性の低さを「オクタン価」で示します。
何故、軽油は発火性の高さを表すのに、ガソリンは発火性の低さを表すのかというと、軽油は自然発火しやすい方が良いとされ、ガソリンは自然発火しづらい方が良いとされているためです。
ちなみにご存じの方は多いと思いますが、車の燃料になるガソリンの「ハイオク」というのは、「ハイ(高い)オクタン価」の略称です。
関連記事
カテゴリーから探す
キーワードから探す